扩散模型融合架构:技术创新的新前沿
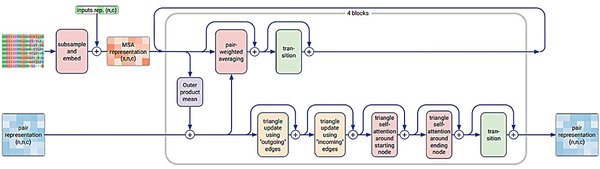
近年来,扩散模型融合架构在人工智能和生命科学领域引发了广泛关注。这一技术的核心在于将扩散模型与几何图神经网络(GNN)相结合,从而实现对复杂生物分子结构的精确预测和设计。DeepMind最新迭代的AlphaFold 3正是这一技术的杰出代表,其在蛋白质-配体复合物结构预测、分子动力学模拟以及药物研发中的应用,展现了前所未有的潜力。
AlphaFold 3:蛋白质设计的革命性突破
AlphaFold 3通过几何图神经网络与扩散模型的融合,显著提升了蛋白质-配体复合物结构预测的精度。这一技术不仅能够预测蛋白质的三维结构,还能模拟其与配体分子的动态结合过程。例如,在新冠病毒刺突蛋白与ACE2受体的动态结合路径解码中,AlphaFold 3展现了其卓越的预测能力。此外,该模型在乳腺癌靶向药研发以及含金属有机框架的酶催化中心结构解析等方面也取得了突破性进展。
药物研发全链条的效率提升
AlphaFold 3在药物研发全链条中的应用也显著提升了效率。从先导化合物筛选到药物毒性预测,再到抗体人源化设计,这一技术为药物研发的各个环节提供了强大的支持。开源社区基于AlphaFold 3构建的自动化药物发现平台,正在推动个性化医疗进入新纪元。例如,通过模拟药物分子在细胞内的反应,研究人员可以优化药物成分,减少临床试验中的失败率。
扩散模型在蛋白质设计中的应用
扩散模型不仅在蛋白质结构预测中表现出色,还在蛋白质设计中展现了巨大潜力。例如,Generate Bio公司开发的Chroma模型首次大规模将扩散模型用于精确的蛋白质设计,能够生成“自然界中完全不存在的蛋白质”。此外,David Baker提出的RFdiffusion通过微调RoseTTAFold结构预测网络,能够生成具有特定功能的蛋白质骨架,为功能蛋白的设计提供了精准的结构基础。
未来展望:个性化医疗的新纪元
随着扩散模型融合架构的不断发展,其在个性化医疗中的应用前景愈发广阔。通过创建患者个性化的AI虚拟细胞,医生可以实时监测患者的健康状态,并为疾病预防和治疗提供科学依据。例如,哈佛大学利用AI虚拟细胞模拟不同基因突变的影响,找到了最佳药物组合。这一技术不仅加速了罕见病的研究进展,还为个性化治疗提供了新思路。
结语
扩散模型融合架构在蛋白质设计和药物研发领域的应用,标志着生命科学和人工智能的深度融合。从AlphaFold 3的突破性进展到个性化医疗的新纪元,这一技术正在重塑生物医学研究的未来。随着技术的不断进步,我们有理由相信,扩散模型融合架构将在更多领域展现出其巨大的潜力,为人类健康和社会发展带来深远影响。
